Western blot은 특정 단백질을 검출하기 위해서
사용하는 실험 방법이다.

- Sample preparing and loading
- SDS-PAGE
- Transfer to membrane
- Primary antibody and washing
- Secondary antibody and washing
- Detection
1. Western blotting 원리
Western blot은 세포나 조직에서 얻은 단백질들에서 특정 단백질 (specific protein)을 검출할 수 있는 실험 방법이다. 기본 원리는 단백질을 size별로 분류한 뒤에 발현 양을 확인하고 싶은 항체를 이용하여 확인 하는 것이다. 즉, 항원-항체 반응을 이용한 단백질의 발현을 확인할 수 있는 실험 방법이다. 그렇다면 각 workflow 별로 좀 더 자세히 알아보도록 하겠다.
전기영동에 영향을 주는 요인들은 세 가지가 있다.
- 단백질의 크기 즉, size이다. 단백질의 크기가 클수록 polyacrylamide gel을 통과하는 속도가 늦어지게 되고 위쪽에 남게 된다.
- 단백질이 갖는 전하 (charge)가 영향을 준다. 전기 영동은 말 그대로 전기로 물질을 움직이게 하는 것이기 때문에 단백질 자체가 전하를 띄게 되면 전기 영동되는 속도가 달라진다.
- 단백질의 구조 또한 전기 영동에 영향을 준다. 사이즈는 같으나 작게 뭉쳐져 있는 단백질 A와 크게 퍼져 있는 단백질 B가 있다. 당연히 작게 뭉쳐져 있는 단백질A가 크게 퍼져있는 단백질 B보다 훨씬 잘 움직일 수 있다.
Western blot의 목적은 size별로 단백질을 분류하고 western blotting 원리인 항원 항체 반응을 이용하여 target 단백질을 검출하는 것이 목적이다. 다시 말하면, 단백질의 전하와 구조라는 변수는 제거 해야 한다는 것이다. 그 방법에 대해서 알아보자.
1) 단백질의 전하 – Western blot에서 SDS의 역할
Western blotting 원리는 항원 항체 반응이지만 아무렇게나 항체를 반응 시키는 것이 아니다. Western blotting 수행하기 위해서 sample을 준비하는 과정을 거쳐야 한다. 이 step에서 굉장히 중요한 역할을 하는 것이 sodium dodecyl sulfate (SDS) 이다. SDS는 detergent로 세포막을 녹여 단백질이 밖으로 나올수 있게 할 뿐만 아니라 단백질을 coating하여 negative charge로 바꾸어 준다. 위에서 말했듯이 전하는 전기영동의 속도에 영향을 줄 수 있다. 하지만, SDS가 모두 음전하로 바꾸어 주었기 때문에 전하라는 변수를 없에고 오직 size로만 분류가 가능하게 하는 것이다.
2) 단백질의 구조 – Western blot β-mercaptoethanol의 역할
이외에도 고려해야 할 것이 바로 단백질의 구조이다. 단백질은 2차 구조, 3차 구조를 형성하고 있어서 사이즈가 같다고 하더라고 어떠한 형태를 띄고 있는가에 따라서 전기 영동에서 다르게 분류될 수 있다. 위에서도 말했듯이 단백질의 size는 같으나 작게 뭉쳐져 있는 단백질과 넓게 퍼져있는 단백질은 전기 영동 할 때 전기에 의해 움직이는 속도가 달라지게 된다. 그래서 모두 같은 구조로 만들어주기 위해서 linear 형태로 만들어주게 된다. linear 구조로 만드는 것이 β-mercaptoethanol이다. β-mercaptoethanol은 이황화 결합 (disulfide bond)를 끊어 주어 단백질이 형성하고 있는 구조를 linear 형태로 바꾸는 역할을 한다.
2. Sodium dodecyl sulfate – Polyacrylamide gel electrophoresis (SDS-PAGE)
Sampling 과정을 거쳐서 준비된 단백질 시료를 SDS-PAGE gel에 loading 하고 전기를 걸어주어 size별로 분류하는 과정이다. polyacrylamide gel이 단백질을 size별로 분류하기 좋은 이유는 다음과 같다.
- 전기적으로 중성이다.
- 친수성이다.
- SDS-PAGE에 사용되는 buffer와 반응하지 않는다.
- 단백질과 결합력이 매우 낮다.
정리하자면 단백질을 size만을 고려하여 분류할 수 있는 gel이라고 생각하면 된다.
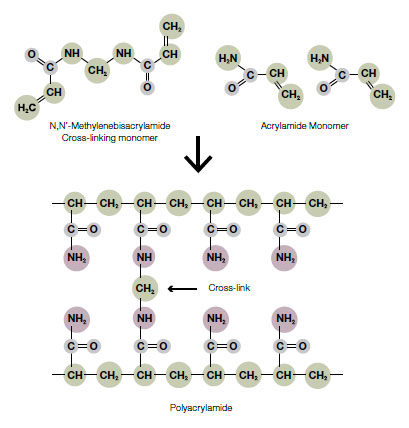
3. Polyacrylamide gel (PAGE)
Polyacrylamide gel은 bis-acrylamdie에 ammonium persulfate (APS)와 tetramethylethylenediamine (TEMED)를 넣어주면 polymerization 시작되며, 이 속도는 온도와 농도에 따라 다르다. Western blot에서는 주로 8~15%의 gel이 사용되는데 % 농도가 높을수록 작은 size의 단백질을 분류하는데 유리하며 반대로 % 농도가 낮을 수록 큰 단백질을 분리하는데 용이하다. .
(출처: https://info.gbiosciences.com/blog/bid/203026/pvdf-or-nitrocellulose-which-membrane-is-best)
Stacking gel 원리 & Separating gel 원리
Stacking gel은 loading 된 sample들을 한 줄로 정렬하게 만드는 gel이다. 즉, 출발선을 맞추어 준다고 생각하면 된다. 보통 4%의 낮은 농도로 만들게 되며 pH가 6.8로 sperating gel (pH8.8) 에 비해 낮다. 이 pH가 단백질을 정렬하게 만드는 결정적인 요인이다. pH가 6.8에서는 각 물질들의 이동 속도가 다음과 같다.
Cl– > protein > Glycine (PI=6.2)
즉, 단백질의 이동 속도가 염소 이온과 glycine 사이에 위치하게 되므로 단백질들이 일직선으로 정렬되게 된다. 하지만, 이 물질들이 pH가 8.8인 saperating gel에 도달하게 되면 이동 속도가 다음과 같이 변화된다.
Cl– > Glycine(PI=6.2) > Protein
그러므로, sperating gel에서는 단백질의 size별로 분류가 가능하게 된다.

4. Transfer (Membrane) 원리
이렇게 분류가 된 단백질들은 blotting membrane으로 transfer 시켜준다. Polyvinylidene difluoride (PVDF) 와 nitrocellulose (NC) membrane이 주로 사용된다. 각 membrane 별 특성은 아래의 표와 같다.
| Binding capacity | Sensitivity | Background noise | |
| PVDF membrane | 170 ~ 200 μg/cm2 | High | High |
| NC membrane | 80 ~ 100 μg/cm2 | Low | Low |
PVDF membrane에 단백질들이 더 잘 달라붙을 수 있으므로 적은 양의 단백질을 검출하기에는 PVDF membrane이 더 좋다. 하지만 그만큼 민감도가 높기 때문에 background가 지저분하다. NC membrane은 반대라고 생각하면 된다. 단백질들이 달라붙는 능력은 좀 떨어지더라도 background가 깨끗하다는 장점이 있다.
Membrane의 pore size도 고려 해야 하는데 보통 0.1, 0.2 or 0.45μm이 쓰인다. 0.45μm를 일반적을 사용하며 15KD까지는 사용해도 무방하다. 하지만 그 보다 작은 사이즈의 단백질을 detection하고자 한다면 pore size를 더 작은 것을 사용 하는 것이 좋다.
5. Western blot blocking 원리
Blocking은 non-specific binding 즉, 비 특이적인 결합을 줄이기 위해서 수행하는 step이다. Blocking에는 주로 BSA나 Skim milk가 주로 사용되며 이는 membrane의 빈 공간 등을 blocking 함으로써 비 특이적인 반응을 줄여 원하는 target에 항체가 더 잘 붙게 하는 효과가 있다.
6. Detection 원리
단백질을 이 membrane들로 transfer해 준 뒤에 검출하고자 하는 단백질의 primary antibody를 붙여준다. 그 후에 비 특이적인 반응을 제거하기 위해서 wahsing을 해준 뒤 secondary antibody를 붙여준다. Secondary antibody에는 Horseradish Peroxidas (HRP)가 붙어있기 때문에 substrate로 넣어주었을 때 빛을 발산하게 되고 이를 film이나 기계로 detection 할 수 있다.
